Селеновая кислота
| Селеновая кислота | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование |
Селеновая кислота(VI) | ||
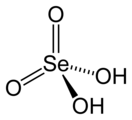
| Хим. формула | H2SeO4 | ||
| Рац. формула | H2SeO4 | ||
| Физические свойства | |||
| Состояние | твёрдое | ||
| Молярная масса | 144,97354 г/моль | ||
| Плотность | 2,95 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 58 °C | ||
| • кипения | 260 °C | ||
| Химические свойства | |||
| Константа диссоциации кислоты | -3 | ||
| Растворимость | |||
| • в воде | (при 30 °C) 130 г/100 мл | ||
| Оптические свойства | |||
| Показатель преломления | (D-линия, 20 °C) 1,5174 | ||
| Структура | |||
| Кристаллическая структура | тетраэдрическая у селен | ||
| Классификация | |||
| Рег. номер CAS | 7783-08-6 | ||
| PubChem | 1089 и 21713352 | ||
| Рег. номер EINECS | 231-979-4 | ||
| SMILES | |||
| InChI | |||
| RTECS | VS6575000 | ||
| ChEBI | 18170 | ||
| ChemSpider | 1058 | ||
| Безопасность | |||
| Пиктограммы СГС |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Селе́новая кислота́ — неорганическая кислота, состоящая из катиона водорода и аниона селената (SeO42-). Химическая формула . Сильная кислота, токсична.
Описание
[править | править код]Селеновая кислота при стандартных условиях представляет собой бесцветное кристаллическое вещество, хорошо растворимое в воде. Ядовита, гигроскопична, является сильным окислителем. Селеновая кислота — одно из немногих соединений, растворяющих золото (наряду с хлорной кислотой, царской водкой, раствором Люголя, цианидами и др.).[1] В твёрдом состоянии она кристаллизуется в ромбическую структуру.
Получение
[править | править код]- Взаимодействие оксида селена(VI) с водой:
- Взаимодействие селена с хлорной или бромной водой:
- Взаимодействие селенистой кислоты или оксида селена(IV) с пероксидом водорода:
Окисление селенистой кислоты кислородом под действием ультрафиолета:
Химические свойства
[править | править код]- Изменение окраски кислотно-основных индикаторов
- Сильный окислитель, более сильный чем серная кислота, даже в умеренно разбавленном растворе (для сравнения даны электродные потенциалы φSO42-/SO32- ~0,169 В, φSeO42-/SeO32- ~1,147 В). Так, например, селеновая кислота способна к окислению соляной кислоты (ввиду большего значения электродного потенциала), в отличие от серной, которая не взаимодействует с ней:
- Горячая, концентрированная селеновая кислота способна растворять золото, образуя красно-жёлтый раствор селената золота(III):
Для получения безводной кислоты в твёрдом кристаллическом состоянии полученный раствор выпаривают при температуре ниже 140 °C (413 К, 284 °F) в вакууме.
Концентрированные растворы данной кислоты вязки. Известны кристаллические моно- и дигидраты. Моногидрат плавится при 26 °C, дигидрат при −51,7 °C.
Селенаты
[править | править код]Соли селеновой кислоты называются селенатами:
- Селенат аммония — (NH4)2SeO4
- Селенат бария — BaSeO4
- Селенат бериллия — BeSeO4
- Селенат золота(III) — Au2(SeO4)3
- Селенат меди(II) — CuSeO4
- Селенат натрия — Na2SeO4
Применение
[править | править код]Этот раздел не завершён. |
Селеновая кислота применяется в основном для получения селенатов.
Примечания
[править | править код]- ↑ Рабинович В. А., Хавин З. Я. «Краткий химический справочник» Л.: Химия, 1977.
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |